近日,国际胃肠肝病学界顶级杂志《Gut》(1区,2019年影响因子19.819)在线发表公共卫生学院微生物学系曹虹团队题为《Bacterial O-GlcNAcase genes abundance decreases in ulcerative colitis patients and its administration ameliorates colitis in mice》的研究性论著。学院与江门市中心医院联合培养博士后何肖龙、高杰为论文共同第一作者,微生物学系主任曹虹为论文核心通讯作者。
O-GlcNAcylation是真核蛋白翻译后修饰的重要方式,由O-GlcNAc水解酶(OGA)和O-GlcNAc转移酶(OGT)控制,在调节肠道炎症中发挥重要作用。既往的研究主要关注于人体来源的酶在参与蛋白O-GlcNAcylation修饰中的作用,而忽略了细菌来源的酶在参与人体蛋白O-GlcNAcylation修饰中的作用。
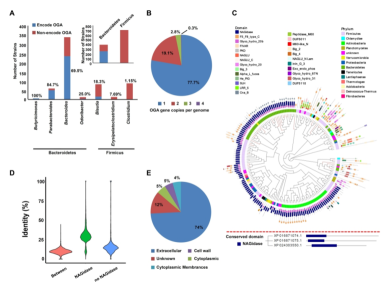
图1.肠道菌群OGAs的物种分布、系统发育及序列特征分析
研究团队首先利用生物信息学分析,系统性揭示了细菌来源的OGA的物种分布及结构特征(图1)。然后,采用宏基因组学分析了来自6个不同国家、涵盖6种不同疾病、共1999个样本中细菌来源的OGA的基因丰度,发现OGA基因丰度在健康人群中很高,但在在溃疡性结肠炎患者中显著下降。进一步,通过体外实验,结合多个炎症性肠病模型,证实了细菌来源的OGA可以水解宿主的o-乙酰糖基化蛋白,抑制炎症通路激活,从而治疗溃疡性结肠炎(图2)。
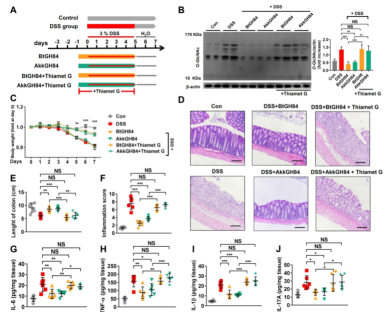
图2.细菌OGAs水解结肠组织中O-GlcNAcylated蛋白以改善小鼠溃疡性结肠炎
该研究首次揭示了细菌来源的OGAs在调控宿主蛋白O-GlcNAcylation修饰中的作用,以及其抑制肠道炎症反应的机制,是微生物糖组学研究方面开创性工作,为细菌来源的OGAs治疗溃疡性结肠炎提供了新思路。
作为英国医学杂志旗下的子刊,《Gut》一直以来被公认为消化领域最顶尖的杂志,尤其在消化道、肝胆和胰腺所报道的临床研究在业界享有盛誉,《Gut》的读者遍布全球各地。










